Entrons dans le détail : Plaidoyer pour l’analyse des effusions
Par le Dr Holly Brown (DVM, PhD, DAVCP), formatrice vétérinaire en chef
L'analyse des épanchements joue un rôle essentiel en médecine vétérinaire. Elle permet aux équipes soignantes d'identifier la cause sous-jacente de l'accumulation de liquide, de classer les épanchements en transsudats ou exsudats, d'orienter le traitement et de suivre l'évolution de la maladie, ce qui conduit à des diagnostics plus précis, à des plans de traitement plus ciblés et à de meilleurs résultats pour les patients.
Une seule goutte de liquide peut fournir une mine d'informations sur l'état d'un patient. Cependant, identifier, prélever et analyser efficacement les liquides relève autant de l'art que de la science. Les conseils et astuces suivants, tirés d'une expérience en milieu hospitalier, peuvent aider les cliniciens à optimiser le processus d'analyse des épanchements afin d'obtenir un diagnostic précis et les meilleurs résultats possibles pour les patients et leurs propriétaires.
Identification des fluides
Les échantillons de fluides vétérinaires sont obtenus principalement par abdominocentèse et thoracocentèse guidées par échographieL'échographie est très performante pour l'identification, car elle permet au clinicien de visualiser même de très petites poches de liquide, ce qui est important car même une goutte de liquide peut fournir des informations significatives.
Conseil de proÉvitez d'utiliser du gel d'échographie pour le prélèvement d'un échantillon cytologique, qu'il provienne d'une masse ou d'un liquide. Même après avoir été essuyé du patient, le gel d'échographie laisse des artefacts granuleux sur les lames colorées, ce qui rend difficile l'identification précise des bactéries ou d'autres détails cellulaires.
Une autre option pour obtenir des échantillons de liquide, notamment chez les patients ayant subi une intervention chirurgicale, consiste à utiliser le liquide recueilli dans un Canalisation Jackson PrattCe liquide est particulièrement efficace pour le suivi post-opératoire des patients porteurs de drains, car les cliniciens peuvent observer (de manière non invasive) les changements de ce liquide sur plusieurs jours afin d'évaluer l'efficacité des antibiotiques, de détecter toute complication chirurgicale et de déterminer le moment opportun pour retirer le drain.
Manipulation des échantillons
Deux types de tubes sont utilisés pour recueillir et traiter les fluides non héminiques. Le premier, et probablement le plus important, est un tube EDTA (bouchon violet). Le second, que l'on peut considérer comme un tube « bonus », est un tube sans additif (bouchon rouge ou blanc, selon le fabricant).
- EDTA dans le tube à bouchon violet Cela empêchera la coagulation de l'échantillon et contribuera à préserver la morphologie cellulaire, maintenant ainsi les cellules saines et fraîches. Ceci est particulièrement important si l'échantillon est envoyé à un laboratoire de référence. Avec les tubes EDTA, ne remplissez pas plus que le volume indiqué (ne pas dépasser ce volume).
- Le Tube sans additif, avec bouchon rouge ou blancCe tube peut servir à des analyses de culture et de biochimie. Ce tube supplémentaire permet de recueillir un échantillon de liquide supplémentaire, si disponible, afin de l'avoir sous la main pour ces analyses complémentaires, au cas où elles seraient nécessaires.
Analyse interne
L'analyse d'un liquide comprend un examen visuel de l'échantillon (couleur et turbidité), la détermination de la concentration protéique et du nombre de cellules nucléées, ainsi qu'une analyse microscopique. Le dosage des protéines totales, le comptage des cellules nucléées et l'identification cellulaire permettent de classer le liquide en transsudat, transsudat modifié ou exsudat.
Couleur et turbidité
Il est important de noter les observations visuelles concernant la couleur et la turbidité, surtout si une lame cytologique doit être envoyée au laboratoire de référence, car le pathologiste clinicien de ce laboratoire ne sera pas en mesure de faire ces observations.
Mesure des protéines
Le dosage des protéines dans un liquide peut se faire de deux manières : par réfractométrie, méthode généralement utilisée pour la densité urinaire et parfois pour le dosage des protéines plasmatiques, ou par analyseur de biochimie clinique. Pour la réfractométrie, déposez une petite goutte de liquide (comme pour la densité urinaire) et observez l’échelle : en plus de celle pour la densité urinaire, il y en a souvent une autre pour le dosage des protéines sériques ou plasmatiques. Avec un analyseur de biochimie, vous pouvez utiliser la lame de dosage des protéines totales fournie avec l’appareil.
Utilisation d'un analyseur d'hématologie pour le comptage des cellules nucléées
La méthode la plus simple pour mesurer le nombre total de cellules nucléées (NTCN) d'un épanchement dans votre clinique consiste à utiliser un analyseur d'hématologie. Ces analyseurs sont d'excellents compteurs cellulaires et permettent d'obtenir rapidement et facilement une numération leucocytaire (GB), dont le résultat peut être extrapolé pour estimer le NTCN du liquide. Certains analyseurs ont été spécifiquement validés pour le comptage cellulaire des épanchements, et certains disposent de programmes dédiés facilitant l'analyse.
Préparation des lames pour l'analyse microscopique
Il existe deux types de préparations cytologiques qui peuvent être utiles pour les analyses de liquides réalisées en interne : les frottis directs et les frottis de sédiment.
Un frottis direct ressemble beaucoup à un frottis sanguin. Prélevez une goutte de liquide du tube EDTA à bouchon violet et déposez-la à l'extrémité postérieure de la lame. Comme pour un frottis sanguin, prenez une lame étalante, inclinez-la légèrement vers l'arrière, en la plongeant dans la goutte selon un angle de 35 à 45 degrés, puis étalez-la le long de la lame pour obtenir un bord net et progressif. Cette préparation directe permet un comptage manuel des cellules nucléées totales.
L'examen du frottis de sédiment est une préparation complémentaire particulièrement utile pour l'analyse des épanchements peu cellulaires. Ce frottis concentre les cellules, permettant ainsi un examen plus efficace. La préparation d'un sédiment liquide commence comme pour un prélèvement de sédiment urinaire : on introduit une petite quantité d'échantillon liquide EDTA dans un tube Eppendorf et on la centrifuge. Le surnageant est éliminé et le culot cellulaire restant au fond du tube est remis en suspension. La lame peut alors être préparée comme pour un frottis direct (similaire à un frottis sanguin), ou bien les cellules peuvent être davantage concentrées par la technique de la ligne. Dans ce dernier cas, une petite goutte de l'échantillon remis en suspension est déposée à une extrémité de la lame, puis une seconde lame est utilisée pour étaler l'échantillon aux trois quarts de la largeur de la lame. La lame porte-échantillon est ensuite soulevée verticalement. On obtient ainsi une ligne de cellules concentrées, facilitant l'examen cytologique de la lame, au lieu d'un bord irrégulier.
Conseil du laboratoireAu lieu d'utiliser un analyseur d'hématologie pour obtenir le nombre total de cellules nucléées, le frottis direct peut être utilisé pour un comptage estimé.
Voici comment :
- Colorer la lame de façon classique avec du Diff-Quik et laisser sécher.
- À l'aide d'un microscope, avec un objectif à immersion d'huile 40x ou 100x, déterminez le nombre moyen de cellules nucléées par champ sur 10 champs. Pour ce faire, comptez dans chaque champ, sur 10 champs, les cellules nucléées (de 1 à 6, etc.), additionnez les résultats et divisez-les par 10 pour obtenir le nombre moyen de cellules nucléées par champ.
- Prenez le nombre moyen de cellules nucléées par champ et multipliez ce nombre par le carré du grossissement de l'objectif. Par exemple, si vous utilisez un objectif 40x, la formule est : Nombre moyen de cellules nucléées par champ x 402 = TNCC/μL. Si vous utilisez un objectif 100x, multipliez le nombre moyen de cellules nucléées par champ par 100.2.
- Le TNCC/μl peut alors être utilisé dans le cadre de la classification des fluides.
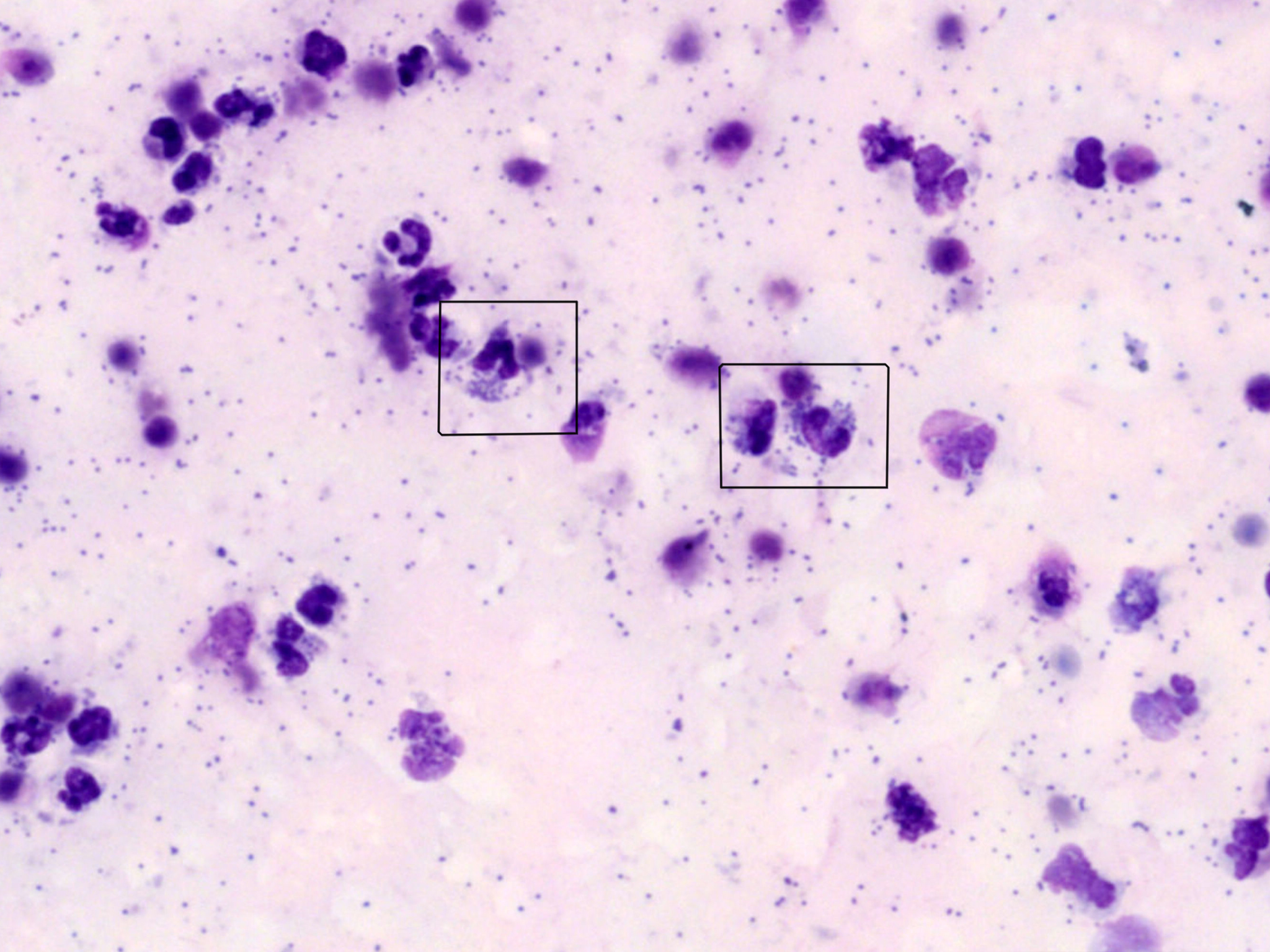
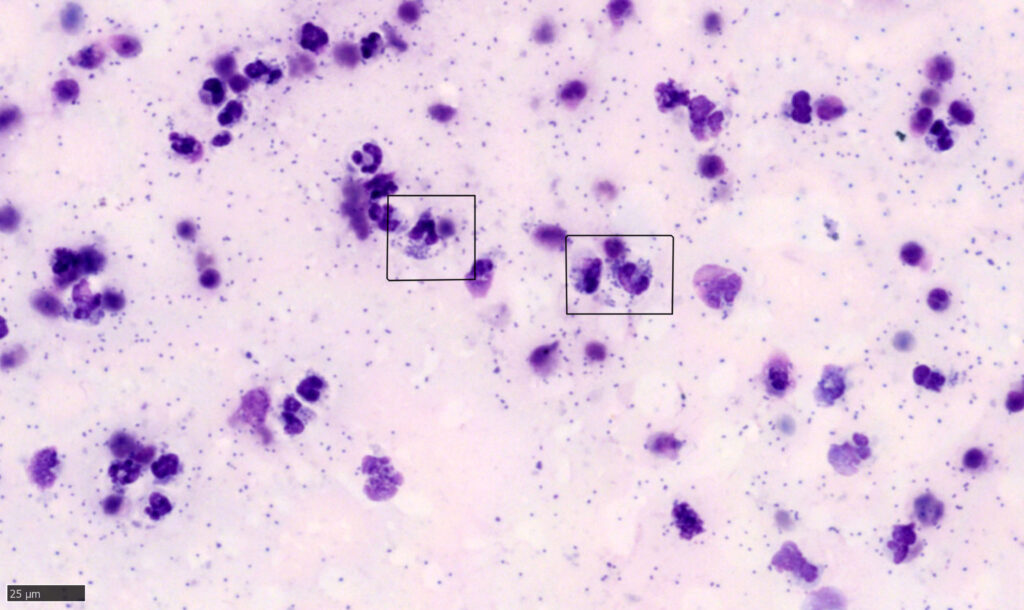
Examen cytologique du liquide
En règle générale (à quelques exceptions près), de nombreuses cellules présentes dans un frottis sanguin peuvent également se retrouver dans un épanchement. Il s'agit notamment des globules rouges et des leucocytes mixtes : neutrophiles, lymphocytes, monocytes, éosinophiles et basophiles. Dans les liquides biologiques, d'autres cellules mononucléées de grande taille, telles que les macrophages et les cellules mésothéliales (qui tapissent les cavités corporelles et la surface des organes), sont classées avec les monocytes parmi les grandes cellules mononucléées. On peut également observer dans les liquides biologiques d'autres types cellulaires, comme les mastocytes, les plasmocytes ou des cellules néoplasiques. En cas de doute sur la morphologie ou l'atypie des cellules, il est préférable de consulter un anatomopathologiste pour confirmer leur identité et interpréter leur signification.
Tests biochimiques
Les tests biochimiques des fluides, et la comparaison avec les valeurs correspondantes dans le sang, peuvent fournir des informations supplémentaires sur les processus pathologiques sous-jacents. Les tests biochimiques sont effectués sur l'échantillon de fluide conservé dans le tube sans additif (à bouchon blanc ou rouge) et peuvent être mesurés par de nombreux analyseurs de chimie clinique qui ne contiennent pas d'additif.
Dans certains cas spécifiques, des analyses biochimiques d'un épanchement peuvent aider à confirmer le diagnostic :
Péritonite biliaire Il s'agit d'une urgence nécessitant une intervention chirurgicale. La rupture de la vésicule biliaire ou une fuite intra-abdominale de bile provenant d'un autre segment des voies biliaires est suggérée par un taux de bilirubine plus élevé dans le liquide biliaire prélevé que dans le sang périphérique.
Péritonite septique Il s'agit d'une autre urgence critique. En cas de suspicion, le dosage du glucose et du lactate peut s'avérer utile. Chez le chien, en cas de septicémie, la glycémie dans l'épanchement est généralement inférieure à celle du sang. À l'inverse, chez le chien, la lactatémie est généralement plus élevée dans l'épanchement que dans le sang en présence d'une septicémie sous-jacente (attention : ce résultat n'a pas été démontré comme fiable chez le chat).
Conseil de proCompte tenu de la variabilité des glucomètres portables, il est déconseillé de les utiliser pour mesurer la glycémie. Veillez également à effectuer les deux mesures simultanément, afin d'obtenir une valeur de glucose fraîche à partir du sang périphérique et de l'échantillon de liquide.
Uroabdomen Il s'agit d'une autre urgence pouvant entraîner un épanchement. Le diagnostic est étayé par des taux élevés de créatinine et de potassium dans l'épanchement par rapport à ceux du sang.
Point clé à retenir : L’analyse des épanchements est un outil de diagnostic essentiel en médecine vétérinaire, offrant de nombreux avantages qui améliorent la prise en charge des patients.
En identifiant, en examinant et en testant les accumulations de liquide provenant des cavités corporelles, les vétérinaires peuvent classer les épanchements, mieux comprendre les processus pathologiques sous-jacents, orienter les stratégies de traitement et surveiller la progression de la maladie pour obtenir les meilleurs résultats possibles pour le patient.
Vous souhaitez en savoir plus sur l'analyse des épanchements ? Écoutez les épisodes de notre podcast « Tails from the Lab » : Discussion technique : Analyse des épanchements (Partie 1) et Discussion technique : Analyse des effusions (Partie 2) Où que vous écoutiez vos podcasts.




